جذب آب طبق استاندارد شماره 4983 ایران این چنین تعریف شده است”افزایش وزن سنگدانه ها بر اثر آبی که در منافذ آن ها موجود است و به صورت درصدی از از وزن خشک سنگدانه ها بیان میشود. سنگدانه زمانی خشک نامیده می شود که به مدت کافی در دمای حدود 110 درجه سانتیگراد قرار گیرد تا تمام آب غیر ترکیبی بر اثر تبخیر از آن ها خارج شود. تخلخل ،نفوذ پذیری و جذب آب سنگدانه ها بروی چسبندگی بین آنها و خمیر سیمان، مقاومت بتون در برابر یخ زدگی و آب شدن ،پایداری شیمیایی بتون، مقاومت به سایش و وزن مخصوص ظاهری تاثیر می گذارد. میزان جذب آب سنگدانه ها بر کارایی بتون موثر است زیرا اگر جذب آب زیاد باشد، آب مخلوط بتون را جذب می کند. شناخت میزان واقعی جذب آب دانه ها در کنترل آب مورد نیاز مخلوط و نسبت آب به سیمان با اهمیت است. طبق دستور تمامی آیین نامه های بتن برای ساخت بتن باید تمامی سنگدانه ها در حالت SSD باشند. میزان و نوع خلل و فرج سنگدانه ها در اندازه های متغیری وجود دارد ولی حتی کوچکترین آن ها از اندازه حفرات ژلی داخل خمیر سیمان بزرگتر است. میزان و سرعت نفوذ آب در سنگ دانه های به اندازه حفره ها و پیوستگی حفره ها به یکدیگر و حجم آنها بستگی دارد.همچنین جذب آب سنگدانه ها باعث کم شدن کارایی بتن به مرور زمان می گردد ولی بعد از حدود 15 دقیقه این افت در کارایی کم خواهد شد. عموما مقدار جذب آب سنگدانه ها متناسب با اندازه و جنس آنها در حالت SSD بین 0.2 تا 4.5 درصد باشد.
بایگانی دسته: مشخصات فنی
ظرفیت تبادل کاتیون خاک (CATIONS EXCHANGE CAPACITY)
ظرفیت تبادل کاتیون خاک (C.E.C) عبارت از حداکثر مقدار کاتیونی است که وزن معینی از خاک قادر است در خود جذب یا نگهداری نماید. این ظرفیت را بر حسب میلی اکی والان در یک صد گرم خاک خشک نشان می دهند. با توجه به آنچه که در جانشینی کاتیون ها به جای یون H+ در کلوئیدهای رس و هوموس گفته شد، اگر این ظرفیت برای خاک معینی T میلی اکی والان باشد و در موقعیت معینی S میلی اکی والان کاتیون در جذب 100 گرم خاک خشک قرار داشته باشد، تفاضل S,T یعنی (T – S) مصرف مقدار هیدروژن موجود در جذب کلوئیدهای همان وزن خاک خواهد بود.
بدین ترتیب ظرفیت تبادل کاتیون یک خاک نماینده مجموعه کاتیون ها و هیدروژن قابل تبادل در جذب یک صد گرم از خاک است +T=S+H. ظرفیت تبادل کاتیون یک خاک اهمیت فوق العاده ای در خواص فیزیکی شیمیایی آن دارد و از آن به عنوان یک مشخصه تعیین نوع خاک استفاده می شود. به طور کلی می توان گفت که هر قدر خاکی از کلوئیدهای معدنی و آلی غنی باشد، این ظرفیت در آن بیشتر است و هر چه خاک در معرض شستشوی کمتری قرار داشته و نیز PH آن خنثی یا به طرف قلیایی میل کند، مقدار S به ظرفیت مزبور نزدیک است، به طوری که در خاک های آهکی (اشباع از کلسیم) و خاک های قلیایی (اشباع از سدیم)، S تقریباً معادل T می باشد. در تعیین مقدار کاتیون قابل تبادل موجود در یک خاک (S)، از خاصیت جانشینی یونها استفاده می شود، بدین ترتیب که کلیه کاتیونهای جذب شده در وزن معینی از خاک را با جانشین کردن کاتیونی دیگر مانند+ NH4 استخراج می نماید ( معمولاً برای این کار از محلول استات آمونیوم استفاده می شود)
در محلول استخراج شده هر یک از کاتیون های Na+2 , k2+,mg+2,ca+2 و غیره را اندازه گیری و از جمع آنها s را تعیین می نمایند. (در این روش به ناچار مقدار جزئی+ NH4 موجود در جذب نمونه اولیه خاک به حساب نمی آید.
هدایت الکتریکی آب (EC)
هدایت الکتریکی آب نشان دهنده میزان املاح هادی موجود در آب میباشد. واحد هدایت الکتریکی که آن را با EC نیز نمایش می دهند ohm-1 یا mho می باشد و واحد هدایت الکتریکی ویژه آب µ mho/cm (میکرو موس بر سانتیمتر) که در سیستم SI با µSiemens/cm (میکرو زیمنس بر سانتیمتر) نمایش داده میشود. معمولاً وقتی از وازه “هدایت الکتریکی آب” استفاده میشود منظور همان “هدایت الکتریکی ویژه آب” میباشد. با توجه به این که هدایت الکتریکی رابطه مستقیمی باTDS و نمکهای محلول در آب دارد، لذا اندازهگیری آن به منظور کنترل کیفیت آب از اهمیت زیادی برخوردار است.
اندازهگیری هدایت الکتریکی
یکی از راههای ساده تعیین غلظت املاح محلول در آب، اندازهگیری هدایت الکتریکی است. آب مقطر یا آب خالص تقریباً هادی جریان الکتریسیته نیست ولی اگر در آب نمکهای محلول وجود داشته باشد، آب را هادی جریان الکتریسیته میکند. هر چه مقدار املاح حل شده در آب بیشتر باشد قابلیت هدایت الکتریکی نیز افزایش مییابد. به عبارت دیگر مقاومت الکتریکی آن کاهش مییابد. با توجه به نقش درجه حرارت در میزان هدایت الکتریکی آب، اندازهگیریها نسبت به درجه حرارت استاندارد که همان ۲۵ درجه سانتیگراد است بایستی اصلاح گردد. هدایت الکتریکی به ازای افزایش هر درجه سانتیگراد تقریباً ۲ درصد افزایش می یابد که می توان آن را بصورت زیر نشان داد:
EC25 =ECt-0.02 (t-25) ECt
pH چیست؟
پ هاش یا pH مخفف (Potential of Hydrogen) به معنی پتانسیل هیدروژن یک کمیت لگاریتمی است که میزان اسیدی یا بازی بودن مواد را مشخص میکند. بیشتر آبزیان فقط در پیاچ بین ۵ تا ۹ زنده میمانند. در واقع این شاخص بررسی غلظت یون هیدروژن در آب می باشد که در اواخر سده نوزدهم برای برخی از صاحبان صنایع شیمیایی اهمیت ویژهای پیدا کرد. به عنوان مثال غلظت یون هیدروژن در طول فرایند تخمیر و فعالیت مخمرها اثر میگذارد و لازم است که غلظت یون هیدروژن دایماً مورد بررسی قرار گیرد. از طرفی چون غلظت یون هیدروژن معمولاً عددی بسیار کوچک است و کار کردن با آن دشوار است، نخستین بار سورِن سِن دانشمند دانمارکی در سال ۱۹۰۹ میلادی مقیاسی به نام pH را بنا کرد. بنا به تعریف، pH برابر منفی لگاریتم مبنای ۱۰ غلظت مولی یون هیدروژن فعال در محلول است.
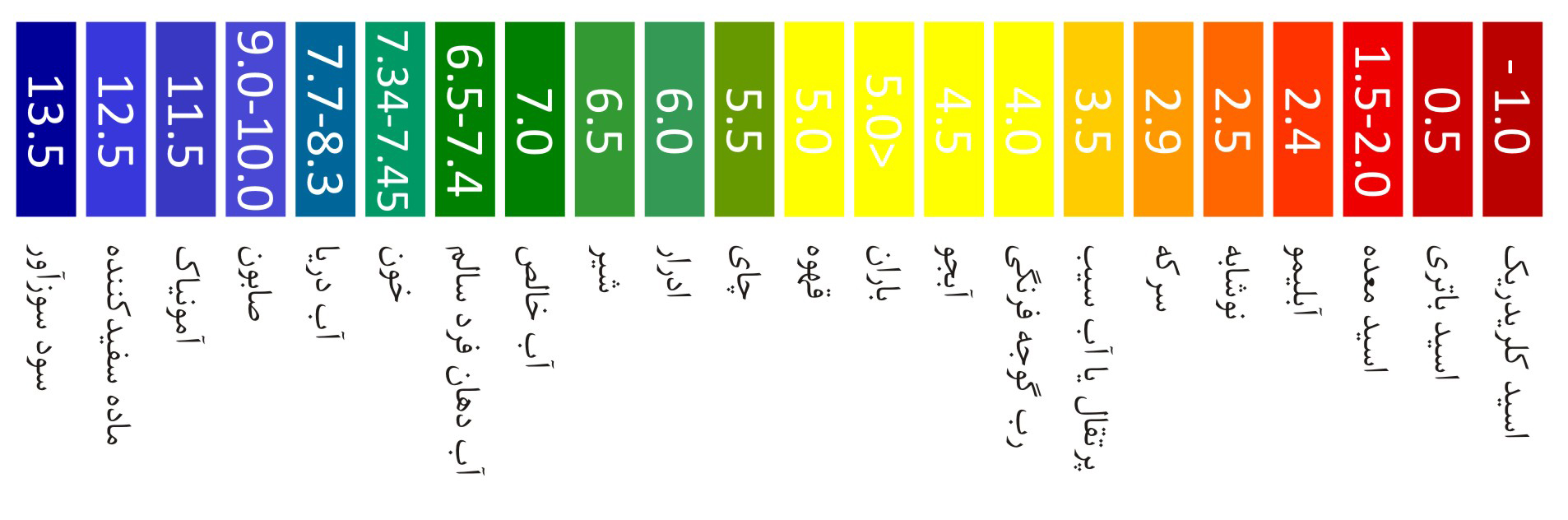
در دمای اتاق(c°25) گسترهٔ بازهٔ pH از (۱۴ ~ ۰) است. عدد صفر اسیدیترین محیط و عدد ۱۴ بازیترین محیط را مشخص میکند. در چنین دمایی، محلولی با pH = ۷ خنثی در نظر گرفته میشود. با بالا بردن دما، گسترهٔ بازهٔ pH کمتر میشود. برای مثال در دمای 85°c این بازه به (۱۳~۰) تغییر میکند. در نتیجه در چنین دمایی، محلولی با pH=۶٫۵ را خنثی فرض خواهیم کرد.
